[연구동향] AUTOTAC chemical biology platform for targeted protein degradation via the autophagy-lysosome system
AUTOTAC chemical biology platform for targeted protein degradation via the autophagy-lysosome system
Nature Communications, 2022


권용태 교수 지창훈 박사
(의과학과) (의과학과)
표적 단백질의 분해는 치료 응용을 위한 약물로 표적하기 어려웠던 단백질(undruggable protein)을 표적화할 수 있을 뿐만 아니라 연구 목적을 위한 관심 단백질을 제거할 수 있다. 프로테아좀이나 리소좀을 이용하는 분해물질(degrader)이 여러 개 개발됐지만 표적을 분해하는 동시에 세포의 오토파지(cellular autophagic flux)를 가속화하는 기술은 아직 없다. 본 연구에서는 오토파지-타겟팅 키메라(AUTOphagy-TArgeting Chimera, AUTOTAC)라는 일반적인 화학 도구 및 플랫폼 기술을 개발하였다. 이 기술은 오토파지-타겟팅 리간드(autophagy-targeting ligands, ATLs)에 연결된 표적 결합 리간드(target-binding ligands, TBLs)로 구성된 이중 기능성 분자를 사용한다(그림1). AUTOTAC은 오토파지의 가장 잘 알려진 수용체인 p62/Sequestosome-1/SQSTM1의 ZZ 도메인에 결합하여 분리(sequestration) 및 분해를 위해 표적과 올리고머 바디(oligomeric bodies)를 형성하며 활성화된다(그림2). 본 연구진은 생체 내외의 다양한 종양단백질(oncoproteins)과 퇴행성 뇌질환에서 분해가 잘 이루어지지 않는 집합체(degradation-resistant aggregates)가 DC50 값이 나노몰러(nanomolar) 단위로 분해하기 위해 AUTOTAC을 사용하였다. 결과적으로 AUTOTAC 기술은 기초 연구는 물론 의약품 개발에서도 선택적으로 단백질을 분해할 수 있는 플랫폼을 제공하며, 더 많은 질병의 치료제 개발에 기여할 수 있을 것이다.
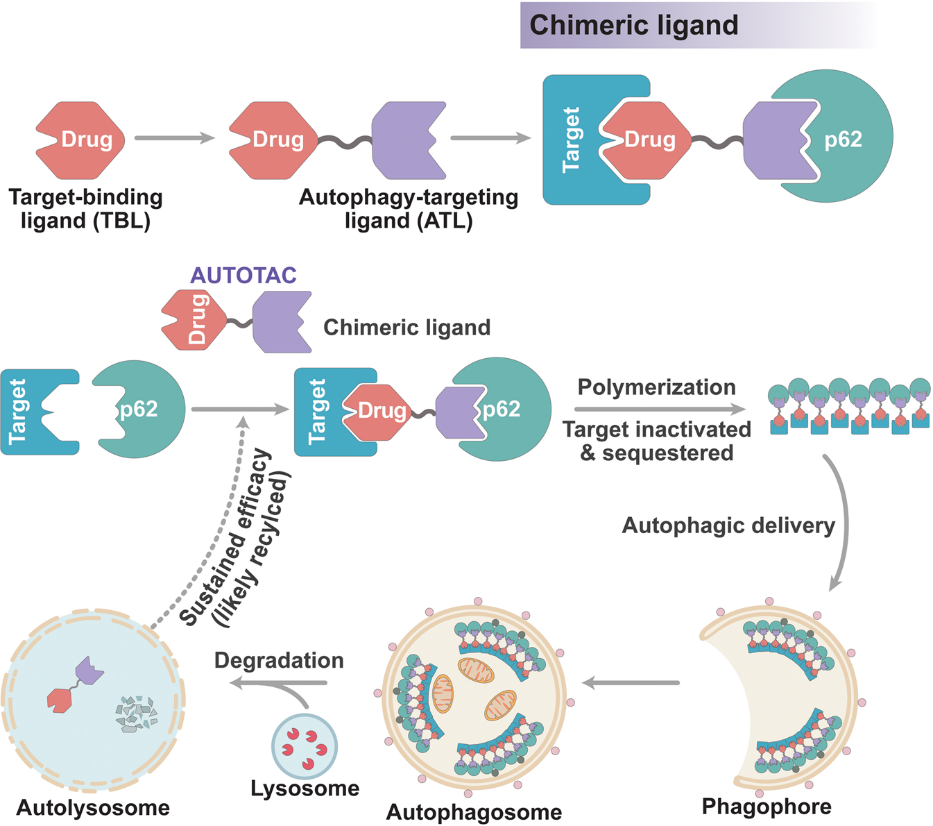
그림1. AUTOTAC의 speculative model과 작용 메커니즘(mechanism-of-action)
그림2. Mode of action을 보여주는 모델들. a 종양단백질(oncoprotiens)을 표적화하는 AUTOTAC. b 복합체(aggregates)를 표적화하는 AUTOTAC

