[연구동향] Molecular architecture of the Gαi-bound TRPC5 ion channel
Molecular architecture of the Gαi-bound TRPC5 ion channel
nature communications, 2023

(생리학교실,교신저자)

(생리학교실,제1저자)
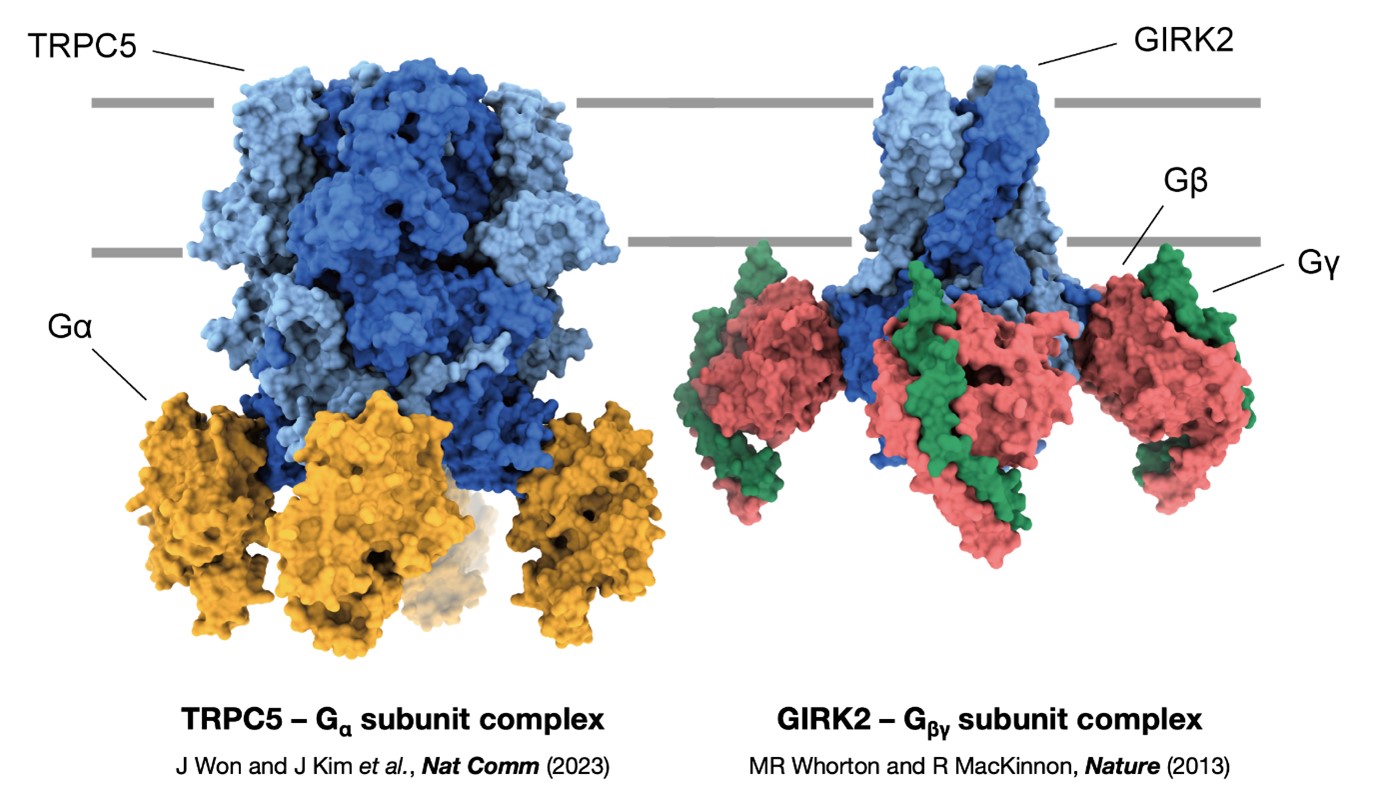
G-protein coupled receptor (GPCR)과 이온통로는 대표적인 막관통단백질들로, 이들의 정상적인 작동은 세포 외부의 자극이 세포 내부로 변환되고 전달되기 위해 필수적이다. 그동안 G-단백질의 α 단위체(Gα subunit)가 이온채널을 직접적으로 활성시킬 수 있다는 가능성이 지속적으로 제시되었으나 이것에 대한 구조적 증거는 전무하였다.
본 논문에서는 서울대학교 의과대학 생리학교실 서인석 교수 연구팀과 서울대학교 자연과학대학 화학부 이형호 교수 연구팀의 공동연구를 통해 동결현미경(cryogenic electron microscopy, cryo-EM) 기법으로 규명한 TRPC5-Gαi3 복합체의 3차원적 구조를 소개하고, 이를 기반으로 실시된 이온채널의 기능적 조절기작에 관한 실험과 분석을 밝혔다. 복합체의 3차원적 구조를 바탕으로 연구진은 4개의 Gαi3가 TRPC5 채널의 ankyrin repeat domain (ARD)에 결합하는 것을 확인하였다. Gαi3가 TRPC5에 결합한 복합체로서의 채널 구조를 확보하였지만, selectivity filter 및 lower gate를 포함하여 채널 중심의 구조를 자세히 분석하였을 때 여전히 채널은 닫힌 상태인 것으로 확인되었다. 이 발견은 전기생리학적 결과와 일치하였는데 즉, 세포 안쪽에 PIP2가 공급되지 않으면 Gαi3 독자적으로는 채널이 열릴 확률(open probability, Po)을 크게 증가시키지 못한 결과와 같은 맥락을 이루었다. 결국 Gαi3의 결합이 실질적인 채널의 열림을 유도하기 위해서는 반드시 채널에 PIP2가 결합되어야 한다고 생각하였고, 따라서 Gαi3의 결합, PIP2의 결합, 그리고 Po사이의 열역학적 상관관계를 분석하였다. 결론적으로 Gαi3 결합의 효과는 TRPC5 채널의 PIP2에 대한 해리상수(dissociation constant, KdPIP2)를 낮추는 것으로 나타났다. Gαi3가 없을 때에 KdPIP2는 23.3 ± 1.0 mM이었던 것에 반해, Gαi3가 있을 때에는 10.2 ± 1.0 mM로 나타났다. 후자는 세포 내 생리학적인 PIP2 농도(4-10 mM)와 유사하며, 이 농도에서 Gαi3의 Po 증가효과가 가장 크게 발휘되는 것으로 나타났다.
종합적으로, 본 논문에서 제시된 결과를 토대로 공동 연구진은 다음과 같은 결론을 도출하였다. 첫째, 세포막에 국한된 여타 효소들에 더하여 이온채널은 Gα 단백질에 의해 직접적으로 기능이 조절되는 직접효과인자(direct effector molecule) 중 하나로 여겨질 수 있다. 둘째, GPCR과 이온채널 사이의 기능적 상호작용을 매개하는 인자로서(Gbg 단위체의 결합 혹은 G-단백질 하위 이차전령체계에 의한 간접적 조절에 더하여) Gα 단위체에 의한 직접적 상호작용을 충분히 고려하여야 한다. 이러한 시각은 지금까지 알려지지 않았거나 해석되지 않았던 두 막관통단백질 군 사이의 기능적 상호작용을 풀어낼 수 있는 새로운 접근법이 될 것으로 기대한다.