[연구실소개] 미생물학교실 마크로파지랩
미생물학교실 마크로파지랩

(미생물학교실)
마크로파지는 인체 최전방에서 외부 유입물질에 대하여 탐식작용을 필두로 하는 방어기능을 하며, 동시에 조직 상처 치유 등 항상성 유지에도 기여하는 흥미로운 세포입니다. 저희 마크로파지랩은 석승혁 교수님과 4명의 박사후 연구원 포함 17명의 연구진이 함께하고 있으며, 마크로파지를 공통의 주제로 가지고 다양한 연구를 활발히 수행하고 있습니다.
마크로파지랩은 2010년 서울대학교 의과대학 미생물학교실 내에 시작되어 지금까지 꾸준히 마크로파지의 기원, 타입 및 역할을 규명하여 종양, 감염 및 대사질환을 포함한 질병의 치료를 통한 항상성 유지(homeostasis)에 대한 다양한 연구 성과를 내어 왔습니다. 보다 구체적으로는 아래와 같은 다양한 세부 연구 주제들이 있는데, 서로 상이한 연구임에도 마크로파지라는 공통의 주제를 가지고 있는 만큼 활발한 디스커션과 시너지즘을 내며 연구의 깊이를 더해가고 있습니다.

[1] 마크로파지 분화 타입을 조절하는 인자/key signaling pathway 연구
[2] 마크로파지를 이용한 세포 치료를 위한 타입 조절을 통한 암/염증 등 질병 완화
[3] 체내 장기별 마크로파지 특성 분포 이미징 연구
[4] 마크로파지에 나노크기 물질 전달 및 탐식 용해 관련 기전 연구
[5] 세포내 세균 및 바이러스 감염에 대한 마크로파지 방어 기전 연구
[6] 하등척추동물 및 원생동물에서의 면역시스템 구성 및 분화 특징 비교 연구
적극적인 연구를 통해 최종적으로는 임상에 적용 가능한 치료 방법을 제안하는 것을 목표로 삼고 있으며, 이를 위해 서울대학교 의과대학 내 다양한 임상 교실과 협력연구를 수행하고 있습니다. 그 과정에서 인체 혈액 유래 단핵구, 마우스 조혈모세포, 마우스 성숙 마크로파지 등을 분리하여 세포실험에 이용하고 있으며, 필요에 따라 마우스나 제브라피쉬 질병모델을 이용하기도 합니다. 모든 연구 과정에서 동물복지와 윤리에 대한 고려를 우선시하여 세포실험법을 개발하거나, 제브라피쉬를 활용하는 등 동물실험을 대체하는 방법을 찾기 위한 노력 또한 기울이고 있습니다.
주요 연구 내용
1. 암세포 전이 전 미세환경 내 마크로파지 매개 전이 촉진 기전 규명
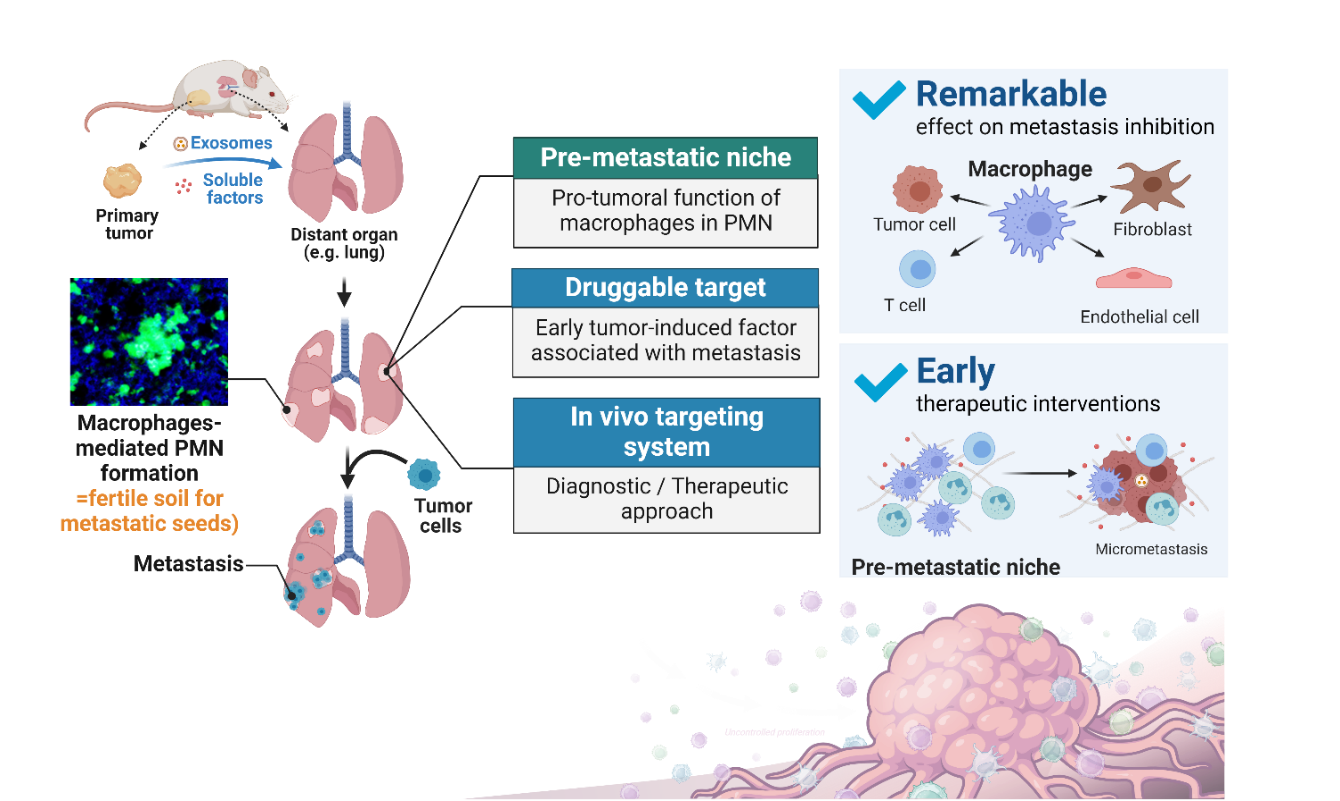
암세포의 전이는 다른 2차 장기에 정착하여 성장하기 위해 암세포가 우호적인 환경인 전이 장기 내 niche를 형성해야 합니다. 이러한 niche 형성은 암세포가 전이 장기로 들어가기 전부터 원발 종양에서 분비되는 다양한 인자에 의해 시작됩니다. 원발 종양 유래 인자는 초기 단계부터 전이 장기 내 마크로파지의 침윤을 증가시키고, 전이 장기 내 pre-metastatic niche를 형성하여 전이 암세포의 침투와 성장을 촉진합니다. 본 실험실은 암세포의 전이 장기 내 침윤 이전에 일어나는 마크로파지 변화를 분석하고 관련 마크로파지 매개 전이 촉진 기전을 검증하며, 암 전이 모델에서 타겟 조절을 통한 전이 억제 유효성을 검증하는 도전적인 목표를 가지고 있습니다. 이를 위해 신규 마커 발굴, 원천기술 확보, 유효성 검증을 진행하고 있으며, 이와 관련한 선행 연구 결과로 암세포의 전이 전 단계에서 마크로파지 매개 미세환경이 암 전이를 촉진하는 기전을 밝혀냈습니다. 최근에는 전이 장기 내 마크로파지를 타겟으로 하는 나노플랫폼을 개발하여 관련 성과를 ACS Nano에 게재했습니다. 이러한 초기 전이 촉진 기전 연구는 암 전이 진단을 조기에 할 수 있고, 암 전이 재발을 억제하는 치료적 타겟으로 활용될 수 있으며, 원발암 외과적 제거 이후 전이 재발에 대한 해결책으로 중요한 역할을 할 것으로 기대됩니다.
2. 마크로파지 대사 조절을 통한 M. massiliense 대한 숙주면역치료법 개발
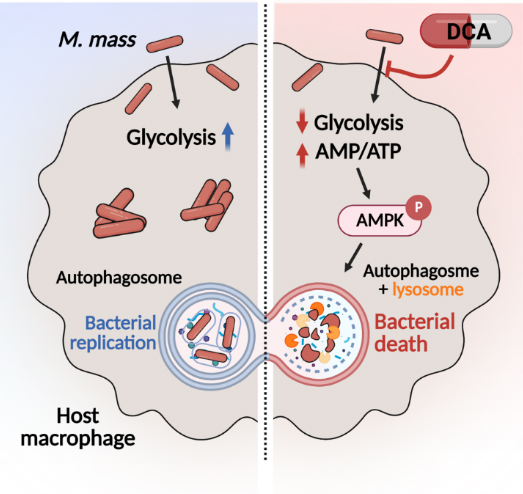
비결핵항산균(NTM)은 결핵균과 나병균을 제외한 항산균입니다. 국내에서는 NTM 폐질환의 주요 특징으로 신속성장균인 Mycobacteroides abscessus (M. abscessus) complex가 20-30% 내외의 환자에서 주요 원인균으로 분리되고 있습니다. 그러나 약제 내성균의 등장과 부작용으로 인해 완전히 치료되는 경우가 드물게 보고되고 있습니다. 따라서 항균제 감수성을 증가시키고 약물의 유효농도를 낮출 수 있는 숙주면역조절법의 개발과 적용이 필요한 상황입니다. 선천면역세포인 마크로파지는 NTM 방어에서 중요한 역할을 담당하며, M. massiliense 감염에 의한 마크로파지의 대사변화 연구에서 pyruvate dehydrogenase kinase (PDK)를 저해하여 미토콘드리아 호흡을 활성화시키고, AMPK 활성을 증가시켜 마크로파지 내 자가포식과 균살상 효과를 나타내어 항균제의 보조치료효과를 증가시킬 수 있음을 확인하였습니다.
3. 장근육층 마크로파지의 장운동성 조절기능 규명
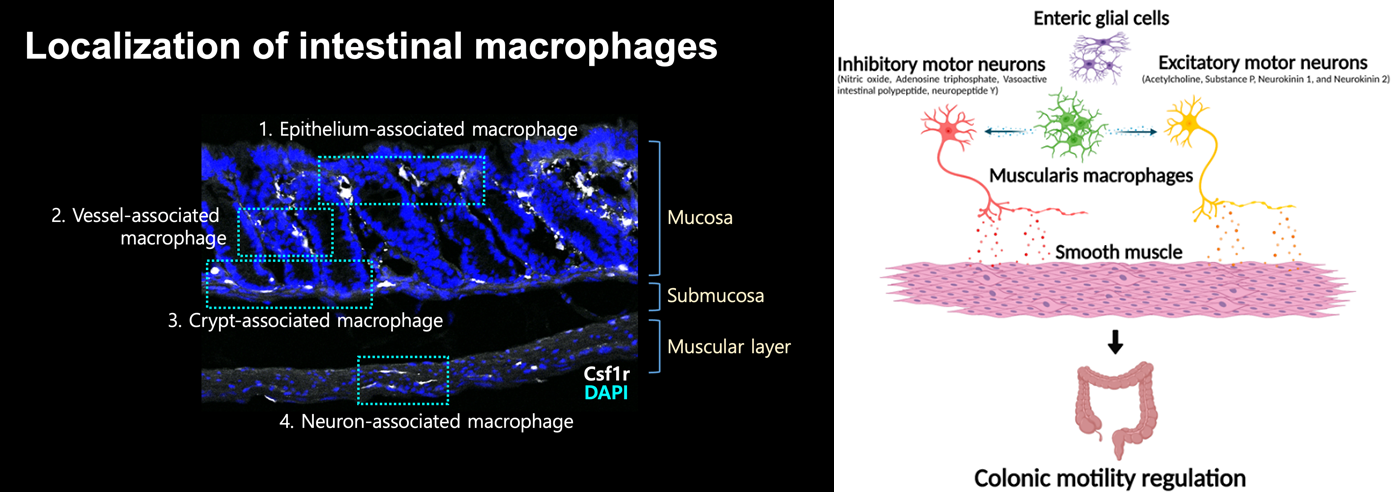
장은 점막층, 점막하층, 근육층, 장막으로 구성되어 있으며, 근육층은 장의 연동운동에 관여하는 중요한 층입니다. 최근 연구에 따르면 장 근육층뿐만 아니라 점막층에서도 마크로파지가 중요한 기능을 수행한다는 것이 알려져 있습니다. 이러한 기전은 장 신경세포와 장 근육층 마크로파지가 성장 인자인 CSF1과 BMP2를 분비하고 수용체로 인식함으로써 세포 수가 조절되는 것으로 이해되고 있습니다. 이로 인해 장 근육층에는 항상 일정한 수의 장 신경세포와 장 근육층 마크로파지가 존재하며, 이 두 세포의 상호작용을 통해 장의 연동운동이 조절된다고 보고되었습니다. 따라서 장 연동운동과 관련된 질환들의 기존 치료 방법과 더불어 장 근육층 마크로파지의 장운동성 조절 기능 연구를 통해 면역세포와 신경관계의 상관관계를 면역학적으로 밝힘으로써 새로운 치료적 접근을 할 수 있을 것으로 기대하고 있습니다.
4. 제브라피쉬를 사용한 당뇨병성 심부전의 약물효과 및 기전 검증
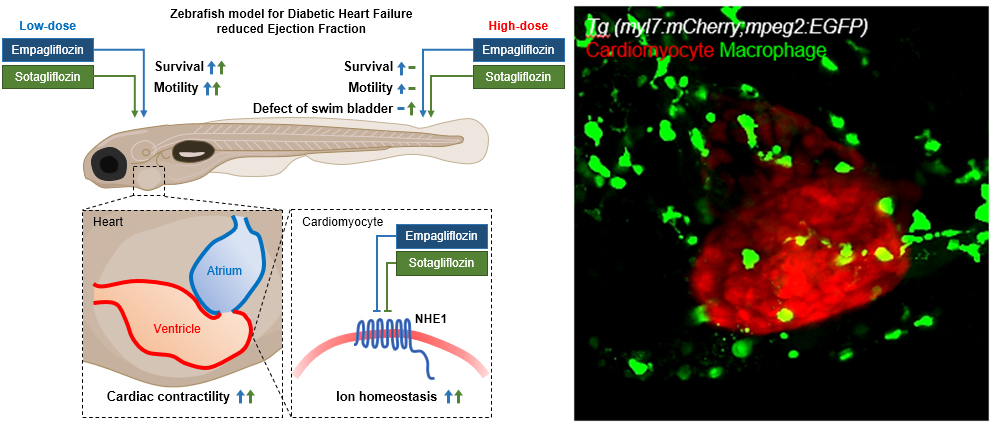
당뇨병환자들은 심부전 유병률과 이로 인한 사망률이 높습니다. 최근 SGLT2 억제제인 Empagliflozin과 Sotagliflozin은 당뇨병과 심부전을 동반한 환자의 생존율을 향상시키는 데 효과적으로 작용한다고 보고되었습니다. 그러나 이러한 약물들이 어떻게 심장을 보호하는지는 아직 알려져 있지 않습니다. 본 연구실은 당뇨병을 동반한 심부전 제브라피쉬 모델을 개발하고, 이를 사용하여 두 약물의 심장 보호 효과를 분석하였습니다. 이 연구에서는 두 약물의 심장 보호 효과를 NHE1이라는 새로운 분자 기전을 통해 설명하였고, 이러한 결과는 Experimental and Molecular Medicine(2023, IF 12.172)에 발표되었습니다. 또한, SGLT2 억제제는 마크로파지의 표현형을 조절하는 것으로 알려져 있지만, 이것이 당뇨병성 심부전에 어떤 영향을 미치는지는 아직 명확히 밝혀지지 않았습니다. 제브라피쉬를 사용하여 마크로파지와 심장을 실시간으로 관찰할 수 있는 주요한 시스템을 활용하여 당뇨병성 심부전의 병인 기전에서 마크로파지의 역할을 밝히고, 이를 통해 치료 전략을 제시할 수 있을 것으로 기대됩니다.
5. 상어의 종양 억제 메커니즘 확인 및 인체 암 치료 타겟 발굴
본 연구실은 선천면역시스템의 진화적 origin에도 관심을 가지고 다양한 연구를 진행하고 있습니다. Animalia 계통수상 두 포인트에 중점을 두고 연구를 수행하고 있는데 그 중 한 가지가 상어를 포함하는 superorder Selachimorpha의 종양 억제 메커니즘에 대한 연구입니다. 상어는 선천면역+후천면역의 네트워크를 진화적으로 최초로 갖추기 시작한 동물로, 이들의 선천면역시스템은 가장 primitive한 형태의 후천면역시스템과 소통하면서도 해당 종을 4억 5천만 년간 지구상에 생존시켜 왔습니다. 이들의 선천면역시스템에 대한 연구는 사실상 거의 이루어진 바가 없는데, 이에 본 연구실은 상어의 혈중 면역세포 재 분류 및 면역장기 구성세포들의 유세포분석을 필두로 하여 이들의 선천면역 시스템에 대한 체계적 분석 중에 있습니다. 이에 더하여 상어의 종양 저항성에 대한 메커니즘을 밝히고, 이러한 저항성과 이들의 면역체계 사이의 연관관계를 밝히고자 상어를 대상으로 하는 다양한 in vivo, in vitro, in silico 분석들을 수행 중에 있습니다. 이를 통하여 최종적으로는 상어의 선천면역시스템이 primitive한 후천면역시스템의 한계를 어떤 식으로 보완하고 있는지, 동시에 이들의 면역계가 상어의 종양 저항성에 어떻게 기여하는지를 밝히고 최종적으로는 인체 암 치료 타겟 발굴에 기여할 수 있을 것으로 기대합니다.
대표 논문
Comparison of the Effects of Empagliflozin and Sotagliflozin on a Zebrafish Diabetic Heart Failure with Reduced Ejection Fraction Model. Kim I, Cho HJ, Lim S, Seok SH (교신저자), Lee HY*. Exp Mol Med 2023. (IF 12.172).
Pyruvate dehydrogenase kinase inhibitor Dichloroacetate augments autophagy mediated constraining the replication of Mycobacteroides massiliense in macrophages. Quan H, Chung H, Je S, Hong JJ, Kim BJ, Na YR *, Seok SH (교신저자). Microbes Infect 2023. (IF 9.57).
Mannosylated-serum nanoparticles imaging to monitor tumor-associated macrophages under anti-PD1 treatment. Gu GJ, Chung H, Park JY, Yoo R, Im HJ, Choi H *, Lee YS *, Seok SH (교신저자). J Nanobiotechnology 2023. (IF 9.429).
Circulation Time-Optimized Albumin Nano platform for Quantitative Visualization of Lung Metastasis via Targeting of Macrophages. Chung H, Park JY, Kim K, Yoo RJ, Suh M, Gu GJ, Kim JS, Choi TH, Byun JW, Ju YW, Han W, Ryu HS, Chung G, Hwang DW, Kim Y, Kang HR, Na YR, Choi H, Im HJ, Lee YS *, Seok SH (교신저자). ACS Nano 2022. (IF 18.027).
Prostaglandin E2 Receptor PTGER4-expressing macrophages promote intestinal epithelial barrier regeneration upon inflammation. Na YR, Jung D, Stakenborg M, Jang H, Gu GJ, Jeong MR, Suh SY, Kim HJ, Kwon YH, Sung TS, Ryoo SB, Park KJ, Im JP, Lee YS, Han H, Park B, Lee S, Kim D, Lee HS, Cleynen I, Matteoli G*, Seok SH (교신저자). Gut. 2021. (IF 31.793).
Protein Kinase A Catalytic Subunit Is a Molecular Switch that Promotes the Pro-tumoral Function of Macrophages. Na YR, Kwon JW, Kim DY, Chung H, Song J, Jung D, Quan H, Kim D, Kim JS, Ju YW, Han W, Ryu HS, Lee YS, Hong JJ, Seok SH (교신저자). Cell Rep. 2020. (IF 9.995).
Macrophages-triggered sequential remodeling of endothelium-interstitial matrix to form pre-metastatic niche in microfluidic tumor microenvironment. Kim H, Chung H, Kim J, Choi DH, ShinY, KangYG, KimBM, SeoSU, Chung S*, Seok SH (교신저자)*. Advanced Science. 2019. (IF 17.521).
Macrophages in intestinal inflammation and resolution: a potential therapeutic target in IBD. Na YR, Stakenborg M, *, Seok SH (교신저자), MatteoliG*. Nat Rev Gastroenterol Hepatol. 2019. (IF 46.802).

연구진 구성: 석승혁 교수님, 정혜원 박사님, 김인호 박사님, 김상화 박사님, 곽동욱 박사님, 한승희 연구원, 이정화 연구원, 전해련(박사과정), 정현종(박사과정), 정미르(석박통합과정), 박지수(석박통합과정), 조유림(석박통합과정), 박규미(석박통합과정), 강동수 (박사과정), 송영민 (박사과정), 김나현 (석사과정), 박연지 (석사과정) 총 17명

