[연구동향] Targeted degradation of α-synuclein aggregates in Parkinson’s disease using the AUTOTAC technology
Targeted degradation of α-synuclein aggregates in Parkinson’s disease using the AUTOTAC technology
Molecular Neurodegeneration, 2023

(의과학과,교신저자)

(의과학과,제1저자)
전 세계 노인 인구의 10% 이상이 퇴행성 뇌질환을 앓고 있다. 그중 파킨슨병은 전 세계 65세 이상 인구의 2~3%에 해당하는 1천만 명이 고통을 받고 있다. 초고령화 사회로 진입하면서 그 숫자는 기하급수적으로 증가하고 있으나 근원 치료제는 전무하다. 파킨슨병은 뇌속의 알파-시누클린(α-synuclein) 단백질이 응고되어 분해되지 않아 축적되면서 도파민성 신경세포가 손상 및 사멸되어 발생한다. 도파민 결핍은 운동 기능 및 인지 장애 등을 일으켜 궁극적으로 생체기능을 파괴한다. 현재 임상적으로 쓰이는 약물들은 도파민 생성을 조절하는 도파민 활성화 약제들로써 근원치료제가 아니라 대증요법이라고 할 수 있다. 따라서 파킨슨병의 근원치료제 개발을 위해서는 질병의 일차적 원인인 단백질 응고체를 환자의 뇌에서 표적분해할 수 있는 혁신적 신약개발이 절실하다.
권용태 교수 연구팀에서는 선행연구에서 오토파지 기반 단백질 표적분해기술을 개발해서 AUTOTAC (autophagy-targeting chimera) 이라 명명했다 (22’ Nature Commun. 13:904). AUTOTAC은 이중약물로 이루어서 1차 약물은 질병유발 물질에 결합하고, 2차 약물이 오토파지 조절인자인 p62에 결합하면, p62가 질병 단백질을 리소좀에 전달해서 분해시킨다. 본 기술을 이용하면 동일한 방식으로 대부분의 질병 관련 단백질을 표적분해할 수 있어 신약개발 플랫폼으로 이용할 수 있다.
본 연구에서는 AUTOTAC 플랫폼을 이용해서 파킨슨병의 원인인 알파-시누클린 응고체를 특이적으로 인식해서 오토파지 경유 리소좀 매개 분해를 유도하는 키메라 저질량화합물 ATC161을 개발하였다. ATC161은 정상적으로 기능을 하는 알파-시누클린 단백질을 인식하지 않고, 병인 응고체만 특이적으로 인식해서 리소좀에 의한 분해를 유도하였다. 또한 병인 응고체에 의한 DNA 및 미토콘드리아 손상에 대한 강력한 치료 효과를 보였다. ATC161은 파킨슨 모델 쥐에 10 mg/kg의 dose로 경구 투여하였을 때 뇌에서 효과적으로 알파 시누클린 응고체를 분해하였다. 또한, 아교세포(glia)의 염증반응을 완화하였으며, 행동실험에서는 근력과 운동능력이 향상되었다. ATC161은 rat와 dog를 대상으로 하는 4주 반복 GLP 독성시험에서 NOAEL이 각각 240 및 500 mg/kg을 보이는 등 약물 안전성(safety)이 검정되어 2024년 1분기 임상1상이 계획 중이다.
이번 연구결과를 통해 최초로 파킨슨병을 직접적으로 일으키는 알파-시누클린 응고체를 제거할 수 있는 치료전략을 제시하였을뿐더러, 경구 투여 가능한 임상약물을 개발하였다. 또한, AUTOTAC이 파킨슨병 등 다양한 퇴행성뇌질환을 치료할 수 있는 플랫폼 치료전략이 될 수 있음을 증명함으로써 향후 임상적 의의가 클 것으로 기대된다.
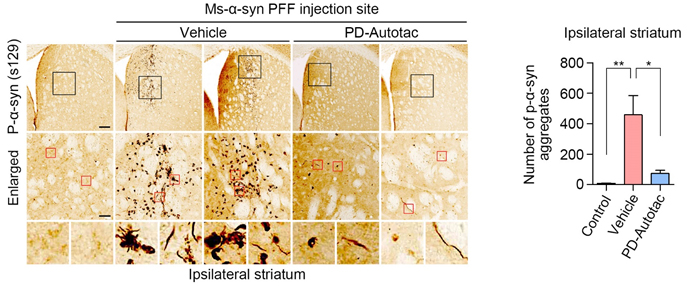
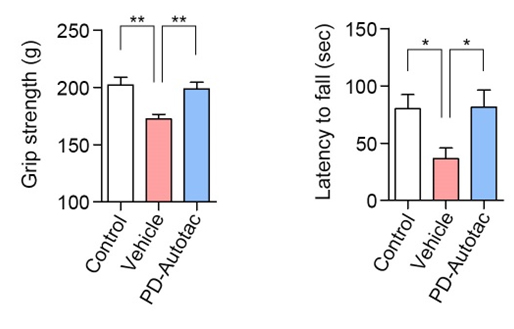
논문링크 : https://molecularneurodegeneration.biomedcentral.com/articles/10.1186/s13024-023-00630-7

